Lorsque j’ai commencé mon voyage dans le monde des «anticorps», j’ai été plutôt choqué par l’absence totale de preuves scientifiques directes de l’existence réelle de ces entités et de leur fonctionnement tel qu’il est décrit. Comme la plupart des gens, je pensais que ce que l’on nous disait sur les «anticorps» et le système «immunitaire» reposait sur des preuves scientifiques solides. Or, c’est exactement le contraire que j’ai découvert. À l’instar des «virus» tout aussi fictifs, les effets observés des processus non naturels créés en laboratoire ont été interprétés comme des preuves de l’existence d’entités invisibles, impliquées d’une manière ou d’une autre dans la cause. Dans le cas de l’«anticorps», cela a commencé par le mélange et la manipulation de sang provenant de différentes espèces, les effets créés étant utilisés comme preuve indirecte de l’existence. Il n’y a eu à aucun moment de purification (absence de contaminants, de matériaux hôtes, de polluants, etc.) ni d’isolement (séparation de tout le reste) de ces soi-disant «anticorps» en vue de les étudier et de les expérimenter). Ces effets créés en laboratoire ont été utilisés par les chercheurs pour imaginer le concept d’une entité causale imaginaire en ce qui concerne son apparence, sa formation et son fonctionnement. Tout ce processus a été initié par les travaux des disciples de Robert Koch, Emil Von Behring et Paul Ehrlich. Alors que Von Behring a présenté l’effet créé en laboratoire, c’est Ehrlich qui a présenté la cause présumée lorsqu’il a exposé sa théorie de la chaîne latérale de la production d’«anticorps» et ses dessins conceptuels de ce que le biologiste français Félix Le Dantec a appelé l’«invalide imaginaire» au début des années 1900.
Comme le note le pathologiste américain Harry Gideon Wells à la page 109 de son livre «The Chemical Aspects of Immunity» (1929), les «anticorps» n’étaient «connus» qu’en raison de la réactivité modifiée des sérums en laboratoire. Ils n’avaient aucune idée de ce qu’étaient les «anticorps» ni même de leur existence en tant qu’objets matériels.
«Nous attribuons cette réactivité modifiée [des sérums] à la présence d’«anticorps», bien que nous ne sachions absolument pas ce que sont ces anticorps, ni même qu’ils existent en tant qu’objets matériels. Comme les enzymes, nous les reconnaissons à ce qu’ils font sans savoir ce qu’ils sont».
Le fait que des effets soient appliqués à des entités inconnues a également été noté dans un manuel allemand de 1910, «Die Methoden der Immunodiagnostik und Immunotherapie» (Les méthodes d’immunodiagnostic et d’immunothérapie), qui admettait que toutes les tentatives d’isoler des «anticorps» avaient échoué. Seuls les effets sont connus, et ces effets sont attribués à des entités inconnues.
«Afin de connaître la nature de ces anticorps, des tentatives ont été faites pour les isoler chimiquement. Jusqu’à présent, tous ces essais ont été infructueux. Il n’est même pas certain que ces soi-disant anticorps soient des entités chimiques définies. Seuls les effets du sérum dans son ensemble sont connus, et les ingrédients qu’il contient et auxquels ces activités sont attribuées sont considérés comme des anticorps».
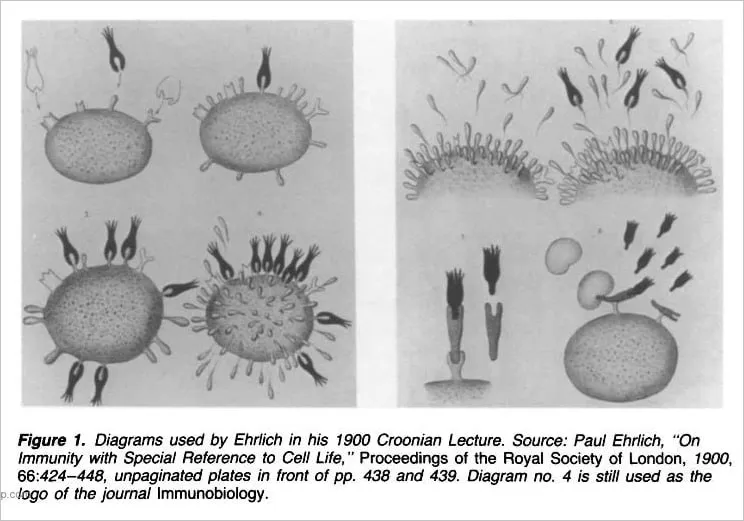
Ce qui a suivi, ce sont des dessins conceptuels d’Ehrlich et d’autres, d’entités appartenant à l’imagination. Comme les «virus», les «anticorps» faisaient partie de ce que l’on appelait le «domaine du comportement invisible des spécimens». Comme le notent Henry Smith Williams et James Beveridge dans leur ouvrage de 1915 intitulé «The Mechanism of Immunization» (Le mécanisme de l’immunisation), «il serait absurde d’imaginer que les diagrammes mécaniques ont une quelconque représentation dans le monde des faits. Ils sont le fruit de l’imagination et peuvent servir à quelque chose d’utile comme les livres d’images servent à enseigner l’alphabet à un enfant». Selon l’article de 1993 intitulé «Ehrlich’s «Beautiful Pictures» and the Controversial Beginnings of Immunological Imagery» (Les «belles images» d’Ehrlich et les débuts controversés de l’imagerie immunologique), les dessins n’étaient pas considérés comme une «image fidèle de la réalité» et beaucoup pensaient qu’ils «devaient être écartés parce qu’ils étaient fondamentalement trompeurs». Le document poursuit en affirmant que la nature matérielle de l’«anticorps» repose sur la foi et que le statut de l’existence de ces entités restera incertain jusqu’à ce qu’elles puissent être correctement purifiées.
«Ainsi, malgré diverses professions de foi sur la nature matérielle des «anticorps», leur statut ontologique restait incertain, une situation attribuée par certains scientifiques à l’incapacité de purifier chimiquement ces entités insaisissables et donc de vérifier s’il s’agissait bien de substances matérielles. Bien entendu, cela revient à poser la question, car pour fonder un argument sur l’éventuelle purification chimique des anticorps, il faut d’abord supposer que les anticorps sont effectivement des substances chimiques distinctes, ce que contestent précisément les adversaires d’Ehrlich».
Les auteurs notent que, pour déterminer si les «anticorps» sont des substances matérielles, il faut poser la question et supposer l’existence des «anticorps» en tant que substances chimiques distinctes. Il s’agit d’une forme de raisonnement logiquement fallacieux où les «prémisses de l’argument supposent la vérité de la conclusion, au lieu de l’étayer. En d’autres termes, vous supposez sans preuve la position, ou une partie importante de la position, qui est en question. Poser la question est également appelé argumenter de manière circulaire». Ce mode de pensée logiquement fallacieux est souvent rencontré en virologie, et il n’est manifestement pas étranger à la recherche sur les «anticorps». En raison de cette incapacité à purifier et à isoler correctement les «anticorps», les auteurs affirment que le débat sur l’existence, la nature et les propriétés des «anticorps» a duré des décennies. De nombreuses théories et idées concurrentes ont été lancées, car les chercheurs n’avaient pas la possibilité de trouver des «anticorps» dans l’environnement naturel supposé du sérum d’un hôte afin de les étudier et de les manipuler au cours de l’expérimentation. L’ensemble du domaine de la recherche sur les «anticorps» était considérablement limité par l’impossibilité d’étudier directement ce que l’on prétendait étudier. Cependant, plutôt que d’essayer de résoudre le problème en trouvant un moyen d’obtenir des «anticorps» de l’hôte dans un état purifié et isolé, la solution a été de se tourner vers l’utilisation des techniques de culture cellulaire popularisées par les virologues afin de créer artificiellement ces entités invisibles avec le développement de ce qui est devenu la technologie de l’hybridome. Voici comment la technologie pseudoscientifique de la culture cellulaire a été à nouveau utilisée en 1975 pour prouver l’existence d’une entité conceptuelle jamais observée dans l’environnement naturel de son hôte.
«Non, il n’existe pas d’anticorps monoclonal qui, parce qu’il est monoclonal, ne reconnaît qu’une seule protéine ou qu’un seul virus. Il se lie à toute protéine ayant la même séquence (ou une séquence très similaire)». – Clifford Saper, l’une des plus grandes autorités mondiales en matière d’anticorps monoclonaux, professeur à la Harvard Medical School.1
«Les anticorps monoclonaux sont des protéines fabriquées en laboratoire qui imitent la capacité du système immunitaire à combattre les agents pathogènes dangereux tels que les virus».2
En 1975, près d’un siècle après qu’Emil Von Behring a émis l’hypothèse de l’existence de substances invisibles dans le sang en 1890, il n’y avait toujours pas de preuve directe que ces substances, désormais connues sous le nom d’«anticorps», existaient réellement comme on le prétendait. De nombreuses hypothèses, théories et expériences de chimie indirecte ont été accumulées au fil des décennies pour étayer ce concept fictif, mais l’«anticorps» en tant qu’unité entière et intacte n’avait jamais été purifié et isolé directement à partir des fluides, visualisé et prouvé qu’il fonctionnait de la manière dont il avait été supposé à l’aide de preuves générées par la méthode scientifique. En fait, l’incapacité de purifier et d’isoler des «anticorps» uniques parmi les milliards qui seraient produits par l’organisme a été un problème majeur qui a entravé l’ensemble du domaine. Il est intéressant de noter que la solution n’a pas consisté à trouver un moyen de purifier et d’isoler les «anticorps» afin de prouver l’existence réelle de ces entités et de les avoir sous la main à des fins d’expérimentation. Les immunologistes ont plutôt eu recours aux mêmes techniques de culture cellulaire que celles utilisées par les virologues pour tenter de créer des «hybrides», appelés hybridomes, pour remplacer les «vrais anticorps». Il s’agit d’un processus tout à fait naturel (sarcasme) qui consiste à fusionner des cellules cancéreuses de souris avec des cellules de rate de souris auxquelles on a injecté du sang de mouton :
La naissance des anticorps monoclonaux
L’histoire des anticorps monoclonaux commence avec l’arrivée de l’émigré argentin César Milstein au Medical Research Council Laboratory of Molecular Biology, à Cambridge, au Royaume-Uni, en 1963. Encouragé par Fred Sanger, qui dirigeait à l’époque la division de la chimie des protéines et des acides nucléiques au laboratoire de biologie moléculaire, Milstein a commencé à étudier la manière dont la diversité des anticorps est générée (étape 10). L’incapacité d’isoler et de purifier des anticorps uniques de spécificité connue parmi les milliards d’anticorps produits par l’organisme constituait à l’époque un problème majeur qui limitait l’ensemble du domaine.
Henry Kunkel, basé à l’Institut Rockefeller de New York, avait noté en 1951 que les cellules de myélome produisaient des anticorps d’une seule spécificité ; par conséquent, les lignées cellulaires de myélome étaient devenues un outil important dans la recherche sur les anticorps. Dick Cotton, un chercheur postdoctoral australien nouvellement arrivé dans le laboratoire de Milstein, a montré en 1973 que la fusion de deux lignées cellulaires de myélome produisant des immunoglobulines produisait une lignée cellulaire hybride qui sécrétait des anticorps de myélome des deux types parentaux. Bien que la spécificité des anticorps produits ne soit pas connue, cette étude est importante pour les travaux futurs, car elle décrit une technique de génération de clones hybrides.
Lors de la présentation de ces travaux à l’Institut d’immunologie de Bâle, Milstein a rencontré le doctorant allemand Georges Köhler, qui a rejoint le laboratoire de Milstein en tant que post-gradué en avril 1974. Bien que plusieurs méthodes de clonage de cellules B produisant des anticorps uniques de spécificité connue aient été décrites – en particulier une technique développée par Norman Klinman à l’université de Pennsylvanie – ces approches présentaient plusieurs limites, notamment un faible rendement en anticorps et une courte durée de vie des cellules. La solution de Köhler et Milstein consiste à générer un hybridome. Avec l’aide de Shirley Howe, technicienne de laboratoire, ils ont fusionné des cellules de la lignée cellulaire de myélome P3-X63-Ag8 (sur laquelle travaillait Cotton) avec des cellules de la rate d’une souris immunisée avec des globules rouges de mouton. Les cellules ont ensuite été incubées dans un milieu hypoxanthine aminoptérine thymidine pendant deux semaines. Les cellules de myélome n’expriment pas l’enzyme hypoxanthine guanine phosphoribosyltransférase, qui est nécessaire à la croissance cellulaire dans ce milieu, et les cellules B non fusionnées ont une courte durée de vie. Par conséquent, seules les cellules fusionnées survivent. Ils ont ainsi généré un hybridome doté de l’immortalité de la cellule myélomateuse et de la capacité de produire des anticorps spécifiques des globules rouges de mouton, qui proviennent de la cellule de la rate. Après avoir surmonté quelques difficultés techniques, ils ont réussi à générer plusieurs hybridomes qui ont sécrété de très grandes quantités d’anticorps monoclonaux.
Dans l’article de Nature décrivant leur découverte, Köhler et Milstein ont fait allusion aux implications potentielles de leurs résultats, déclarant que «ces cultures pourraient être précieuses pour des usages médicaux et industriels». Cependant, l’importance de l’article a été largement ignorée par la revue, qui l’a omis dans la section réservée aux découvertes de première importance. Il a fallu quelques années pour que les implications plus larges de la découverte soient réalisées, mais avec la prise de conscience des avantages potentiels de la technique, comme le souligne un éditorial du Lancet de juin 1977 affirmant que la découverte pourrait «avoir de profondes implications pour la pratique médicale», Milstein a rapidement été inondé de demandes d’échantillons de cellules. Cette découverte a ouvert la voie à la commercialisation précoce de la technologie des anticorps monoclonaux.
Les contributions de Köhler et Milstein à la recherche scientifique ont été officiellement reconnues lorsqu’ils ont reçu le prix Albert Lasker de la recherche médicale fondamentale et le prix Nobel de physiologie ou de médecine, conjointement avec Niels Kaj Jerne, en 1984.
https://www.nature.com/articles/ni.3608
Comme s’il était vraiment nécessaire de le souligner, l’immunologie a certainement franchi le seuil des (pseudo)scientifiques fous au milieu des années 1970 (comme si ce n’était pas déjà le cas). Logiquement, si les «anticorps» existent, les chercheurs devraient être en mesure de purifier et d’isoler correctement ces entités directement à partir du sang, en particulier chez ceux qui sont supposés avoir de grandes quantités d’«anticorps» dans leur sang, soit par «immunisation», soit comme sous-produit d’«infections» naturelles. N’oublions pas que ces entités sont censées être produites par milliards dans le corps. Il faudrait alors pouvoir montrer à quoi ressemblent ces «anticorps» et démontrer s’ils ont réellement un quelconque effet protecteur par le biais de l’expérimentation via la méthode scientifique. Il ne devrait pas être nécessaire de créer et de cultiver artificiellement des «anticorps» en mélangeant des cellules cancéreuses et des cellules de la rate avec un milieu HAT3 composé d’hypoxanthine, d’aminoptérine et de thymidine, des produits chimiques synthétiques, ainsi que de sérum de vache fœtale, d’antibiotiques et d’autres additifs chimiques dans une culture cellulaire. Pourtant, c’est exactement ce qui a été fait. Tout a commencé lorsque les travaux de Georges Köhler, qui aurait été capable de créer des formes cancéreuses de cellules «productrices d’anticorps» de spécificité inconnue, ont été fusionnés avec les travaux de Cesar Milstein, qui aurait été capable de fabriquer des cellules «productrices d’anticorps» de spécificité connue, mais qui n’ont pas survécu longtemps. Le résultat de ce mariage pseudoscientifique a été la naissance de la monstruosité connue sous le nom d’«anticorps monoclonal».
Technologie des hybridomes de Kohler et Milstein (1975)
Nos cellules B, un type de globules blancs, peuvent produire des millions d’anticorps différents. Cependant, chaque cellule ne peut produire à elle seule que des anticorps d’une certaine spécificité prédéterminée, ce qui signifie que de très nombreuses cellules B différentes sont nécessaires pour générer la multitude d’anticorps dont a besoin un système immunitaire en bonne santé. Lorsque l’organisme est exposé à un antigène étranger donné, celui-ci peut provoquer la stimulation d’une cellule B qui a été fortuitement dotée de la capacité d’identifier cet antigène particulier. Cette cellule B commence alors à se diviser pour former un clone de cellules qui produisent des anticorps identiques, ou anticorps «monoclonaux».
C’est ainsi que fonctionne la nature. Mais en 1975, George Kohler et Cesar Milstein, travaillant au laboratoire de biologie moléculaire du MRC à Cambridge, ont trouvé un moyen d’imiter cet effet pour produire des anticorps monoclonaux «sur commande». Pour ce faire, ils ont fusionné des cellules myélomateuses – cellules cancéreuses résultant de la division cellulaire incontrôlée d’un lymphocyte qui se divise pour former un clone de cellules identiques – avec des cellules B productrices d’anticorps. En fusionnant la cellule B avec la cellule myélomateuse, celle-ci acquiert la capacité de se diviser rapidement, ce qui permet de cultiver un grand nombre de cellules identiques productrices d’anticorps en culture cellulaire.
Ce système est connu sous le nom de technologie des hybridomes, car il fait appel à des hybrides cellulaires pour produire des ensembles d’anticorps monoclonaux identiques dirigés contre des antigènes spécifiques. Kohler et Milstein ont commencé à travailler indépendamment l’un de l’autre. Milstein avait développé des formes cancéreuses de cellules productrices d’anticorps qui se développaient et se multipliaient à l’infini, mais qui produisaient des anticorps de spécificité inconnue, tandis que Kohler parvenait à faire produire des anticorps spécifiques par des cellules productrices d’anticorps, mais ces cellules ne survivaient pas très longtemps. En combinant leurs découvertes, ils ont trouvé un moyen de fabriquer des anticorps monoclonaux d’une précision exquise à partir de cellules qui se divisaient indéfiniment et vivaient effectivement éternellement.
Les anticorps monoclonaux, ou «MAbs», ont révolutionné l’immunologie en termes de tests analytiques et de diagnostics, et constituent désormais un traitement standard pour certaines formes de cancer avec des médicaments tels que Herceptin (trastuzumab), Avastin (bevacizumab) et Campath (alemtuzumab).
Kohler et Milstein ont reçu une partie du prix Nobel de physiologie ou de médecine en 1984 pour leur découverte.
https://www.immunology.org/kohler-and-milsteins-hybridoma-technology-1975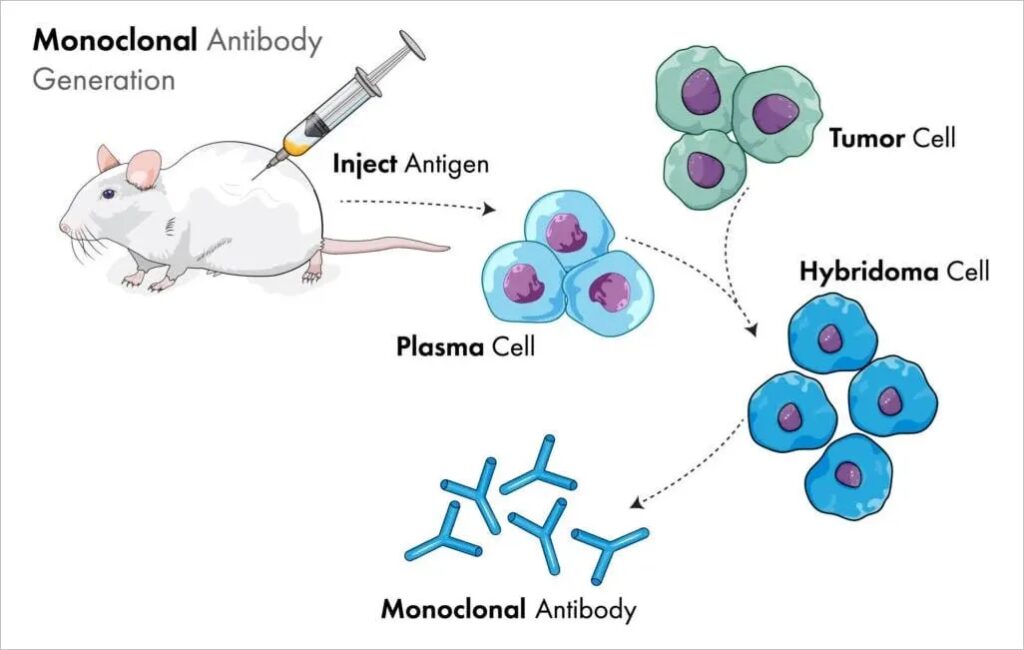
Les mêmes astuces de culture cellulaire non naturelles qui ont été substituées comme «preuve» de l’existence des «virus» à partir de 1954 sont maintenant appliquées aux «anticorps». Les hommes à l’origine de cette transition, Georges Köhler et Cesar Milstein, ont reçu le prix Nobel en 1984 pour avoir mis au point la technique des hybridomes, les scientifiques étant incapables de produire efficacement des «anticorps spécifiques» à l’époque. Le texte du prix Nobel précise que le prix a été décerné «pour des théories concernant la spécificité dans le développement et le contrôle du système immunitaire et la découverte du principe de production d’anticorps monoclonaux». En d’autres termes, ils ont été récompensés pour avoir ajouté leurs propres idées sur la spécificité et le contrôle du système «immunitaire» au récit en constante évolution, ainsi que pour avoir trouvé un moyen de créer artificiellement ces substances invisibles en laboratoire.
S’agissait-il vraiment d’une invention digne d’un prix aussi «prestigieux» ? Le plus grand titre de gloire des «anticorps monoclonaux» de Köhler et Milstein, au-delà de l’affirmation qu’un seul type d’«anticorps» est présent dans un mélange, est leur spécificité supposée par rapport aux «anticorps polyclonaux» produits régulièrement, qui sont censés être constitués de nombreux types différents. Cela signifie que les «anticorps» créés artificiellement sont censés mieux reconnaître les bonnes cibles que ceux que l’on prétend «trouver dans la nature». Cependant, on sait depuis longtemps que les «anticorps monoclonaux» ne sont pas spécifiques et qu’ils se lient régulièrement à des cibles non désirées. En fait, comme l’indique la citation liminaire de Clifford Saper, professeur à la Harvard Medical School et l’une des principales autorités mondiales en matière d’«anticorps monoclonaux», il n’existe pas d’«anticorps monoclonal» qui ne reconnaisse qu’une seule protéine ou qu’un seul «virus», puisqu’il se lie à toute protéine ayant la même séquence (ou une séquence très similaire). Une étude de 2018 a révélé que les «anticorps monoclonaux» ne sont, dans de nombreux cas, même pas «monoclonaux», les résultats montrant que 31,9% des hybridomes produisant des «anticorps monoclonaux» sécrètent en réalité plusieurs «espèces d’anticorps». Selon un article décrivant les résultats, ce cocktail d’«espèces d’anticorps» a entraîné une réduction de la liaison à la cible prévue ainsi que de la liaison à des cibles non prévues. Une autre constatation est que l’abondance relative des «espèces d’anticorps» varie d’un lot à l’autre, ce qui rend difficile l’obtention de résultats reproductibles. L’affirmation selon laquelle les échantillons d’«anticorps monoclonaux» contiennent plusieurs «espèces» est une façon ingénieuse d’expliquer les preuves contradictoires. Toutefois, les problèmes de reproductibilité des «anticorps» sont connus depuis au moins 2015. Cela a conduit à une crise de reproductibilité où de nombreux articles «scientifiques» ont été considérés comme faux en raison des résultats peu fiables, non reproductibles et non irréprochables de l’utilisation de ces concoctions créées en laboratoire.
Un autre avantage supposé découlant de la découverte de ce processus est que ces créations hybrides cancer/animal fabriquées par l’homme sont utilisées comme «thérapies à base d’anticorps monoclonaux» afin de prévenir les maladies graves. Si la création de ces «anticorps» artificiels a été saluée comme une avancée pour leur rôle dans les tests et le traitement des maladies «infectieuses», ainsi que pour la réduction supposée de la toxicité des médicaments et la suppression des rejets dans les greffes d’organes, il ne faut pas s’étonner que ces hybrides cancer de la souris/cellules de la rate comportent divers effets secondaires et risques admis liés à leur utilisation chez l’homme. Les réactions dangereuses connues comprennent le développement d’une anaphylaxie aiguë, d’une maladie sérique, de maladies auto-immunes, d’«infections» et de cancers, d’effets indésirables spécifiques à certains organes et, pour une raison étrange, la production d’«anticorps» eux-mêmes :
Sécurité et effets secondaires des anticorps monoclonaux
«Les anticorps monoclonaux (AcM) sont désormais reconnus comme des thérapies ciblées pour les tumeurs malignes, le rejet des greffes, les maladies auto-immunes et infectieuses, ainsi que pour toute une série de nouvelles indications. Cependant, l’administration d’AcM comporte le risque de réactions immunitaires telles que l’anaphylaxie aiguë, la maladie sérique et la production d’anticorps. En outre, de nombreux effets indésirables des AcM sont liés à leurs cibles spécifiques, notamment les infections et le cancer, les maladies auto-immunes et les effets indésirables spécifiques à certains organes tels que la cardiotoxicité. En mars 2006, un syndrome de libération de cytokines mettant en jeu le pronostic vital est survenu au cours d’une première étude chez l’Homme avec le TGN1412 (un AcM superagoniste spécifique de CD28), ce qui a donné lieu à une série de recommandations visant à améliorer la sécurité des premières études cliniques chez l’homme avec des AcM. Nous passons ici en revue certains des effets indésirables rencontrés avec les thérapies par AcM et discutons des avancées dans les tests précliniques et la technologie des anticorps visant à minimiser le risque de ces événements».
https://pubmed.ncbi.nlm.nih.gov/20305665Cela semble «sûr et efficace», tout comme les vaccins (notez le sarcasme à nouveau). En avril 2022, j’ai examiné les «thérapies à base d’anticorps monoclonaux» et les similitudes qu’elles présentent avec les antivenins de serpent dans l’article «Beware the Snake Oil Salesmen» (Méfiez-vous des vendeurs d’huile de serpent). J’ai notamment examiné le mode de fabrication de ces thérapies, leur inefficacité avérée et les effets toxiques similaires des traitements. Les preuves présentées dans l’article concernaient l’utilisation d’«anticorps monoclonaux» pour le «Covid-19» et démontraient que ces thérapies étaient non seulement inefficaces, mais aussi dangereuses. Par exemple, selon une revue Cochrane de septembre 2021 portant sur les études disponibles, les preuves sont insuffisantes pour affirmer que les «anticorps monoclonaux» constituent un traitement efficace du «SRAS-COV-2».
Les anticorps monoclonaux spécifiques du COVID-19 fabriqués en laboratoire constituent-ils un traitement efficace du COVID-19 ?
«Les preuves de chaque comparaison sont basées sur des études uniques. Aucune d’entre elles n’a mesuré la qualité de vie. Notre certitude quant aux données probantes est faible pour toutes les personnes non hospitalisées et très faible à modérée pour les personnes hospitalisées. Nous considérons que les données actuelles sont insuffisantes pour tirer des conclusions significatives concernant le traitement par AcM neutralisant le SARS-CoV-2».
https://www.cochrane.org/CD013825/HAEMATOL-are-laboratory-made-covid-19-specific-monoclonal-antibodies-effective-treatment-covid-19
En d’autres termes, les preuves de l’utilité des «anticorps monoclonaux» sont inexistantes. Malheureusement, l’étude Cochrane a omis de souligner que leur utilisation comporte divers risques et effets indésirables :
Les AcM présentent-ils des risques ?
«Les AcM thérapeutiques, généralement administrés par perfusion intraveineuse (IV), constituent depuis de nombreuses années une option thérapeutique précieuse et généralement sûre pour diverses affections. Cependant, ils sont également connus pour provoquer une série d’effets secondaires et de réactions, qui peuvent être immédiats ou différés. Les effets indésirables graves associés aux AcM comprennent les réactions à la perfusion, l’anaphylaxie aiguë et la maladie sérique, ainsi que des complications à plus long terme telles que les infections, le cancer, les maladies auto-immunes et la cardiotoxicité».
https://www.ecri.org/components/PPRM/Pages/QAMonoclonalAntibodyCOVID19.aspx?PF=1&source=printEn raison de cette inefficacité et des effets dangereux associés à cette thérapie, la FDA a retiré l’autorisation d’utilisation d’urgence (EUA) de plusieurs «anticorps monoclonaux», car il a été déterminé que les divers risques liés à l’utilisation de ces traitements l’emportaient sur les «avantages» non prouvés. Bien sûr, il y avait l’excuse intégrée de l’inefficacité des traitements. Dans ce cas, l’histoire tournait autour de la supposée mutation du «virus» rusé et de son évasion des effets «protecteurs» des «anticorps». En d’autres termes, ce n’est pas que le traitement était inefficace et dangereux, c’est que le «virus» a changé de vêtements et s’est à nouveau déguisé avec succès, trompant les défenseurs des «anticorps» et les empêchant de fournir une protection contre une maladie grave. Les «AcM» rappelés ont ensuite été remplacés par des «versions actualisées».
Les anticorps monoclonaux peuvent-ils encore être utilisés pour traiter le COVID-19 ?
«Comme chaque type d’anticorps monoclonal est soigneusement conçu pour agir contre une protéine spécifique du virus COVID-19, une mutation de cette protéine virale pourrait rendre l’anticorps monoclonal inefficace. En effet, c’est exactement ce qui s’est produit au fur et à mesure de l’évolution des différentes variantes du COVID-19. En fait, la FDA a restreint ou même retiré son autorisation d’utilisation d’urgence de certains anticorps monoclonaux qui ne sont pas efficaces contre la variante omicron».
https://health.osu.edu/health/virus-and-infection/monoclonal-antibodies-still-treat-covid-19On voit donc que les affirmations concernant l’utilité des «anticorps monoclonaux» créés artificiellement sont plutôt inexactes, car ces concoctions de culture cellulaire ne sont régulièrement pas spécifiques, ne sont pas d’un seul type, conduisent à des résultats non reproductibles et peuvent provoquer des maladies graves et la mort lorsqu’elles sont utilisées en tant que traitement. Il convient donc de se demander quels «avantages décisifs» ont été apportés par la «découverte» de Köhler et Milstein qui méritait de leur décerner un prix Nobel.
Cette preuve devrait suffire à inciter quiconque à reconsidérer les affirmations relatives aux avantages et à l’utilité des «anticorps monoclonaux». Toutefois, pour souligner davantage l’absurdité de ces entités, examinons les méthodes pseudoscientifiques de l’article qui a abouti à leur «découverte» afin de conclure l’affaire. Vous trouverez ci-dessous l’article de Köhler et Milstein, lauréat du prix Nobel en 1975, pour votre plus grand plaisir. En lisant ce document, demandez-vous en quoi les expériences réalisées reflètent la nature d’une manière ou d’une autre. Quelle est l’hypothèse basée sur un phénomène naturel observé ? Quelle était la variable indépendante (cause présumée) de l’expérience et quelle était la variable dépendante (effet étudié) ? Des contrôles appropriés ont-ils été effectués ? N’oubliez pas qu’aucun des tests utilisés pour détecter et mesurer ces soi-disant «anticorps» dans cette étude n’a jamais été calibré et validé pour des «anticorps» purifiés et isolés prélevés directement dans le sang. La présence de ces entités est supposée sur la base de preuves indirectes. Il n’y a aucune micrographie électronique montrant des «anticorps monoclonaux» purifiés et isolés, ce que l’on pourrait supposer être assez facile à obtenir à partir d’un produit prétendument constitué uniquement de particules en forme d’Y. Quoi qu’il en soit, je laisserai au lecteur le soin de décider de la valeur scientifique de cet article et s’il doit ou non servir de preuve de l’existence de ces entités tout à fait hypothétiques.
Cultures continues de cellules fusionnées sécrétant des anticorps de spécificité prédéfinie
La fabrication d’anticorps spécifiques prédéfinis au moyen de lignées cellulaires permanentes de culture tissulaire est d’un intérêt général. Il existe actuellement un nombre considérable de cultures permanentes de cellules de myélome et des procédures de dépistage ont été utilisées pour révéler une activité anticorps dans certaines d’entre elles. Il ne s’agit cependant pas d’une source satisfaisante d’anticorps monoclonaux de spécificité prédéfinie. Nous décrivons ici la dérivation d’un certain nombre de lignées cellulaires de culture tissulaire qui sécrètent des anticorps anti-globules rouges de mouton (SRBC). Ces lignées cellulaires sont issues de la fusion d’un myélome de souris et de cellules de la rate de souris provenant d’un donneur immunisé. Pour comprendre l’expression et les interactions des chaînes d’Ig des lignées parentales, des expériences de fusion entre deux lignées connues de myélome de souris ont été réalisées.
Chaque chaîne d’immunoglobuline résulte de l’expression intégrée d’un des nombreux gènes V et C codant respectivement pour ses sections variables et constantes. Chaque cellule n’exprime qu’un seul des deux allèles possibles (exclusion allélique ; voir réf. 3). Lorsque deux cellules productrices d’anticorps sont fusionnées, les produits des deux lignées parentales sont exprimés, et bien que les chaînes légères et lourdes des deux lignées parentales soient jointes de manière aléatoire, aucun signe de brouillage des sections V et C n’est observé. Ces résultats, obtenus dans un système hétérologue impliquant des cellules d’origine rat et souris, ont maintenant été confirmés en fusionnant deux cellules de myélome de la même souche de souris, et fournissent le contexte pour la dérivation et la compréhension des lignées hybrides sécrétant des anticorps dans lesquelles l’une des cellules parentales est une cellule de la rate produisant des anticorps.
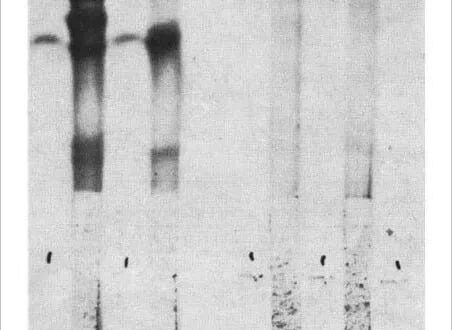
Deux lignées cellulaires de myélome d’origine BALB/c ont été utilisées. PI Bul est résistante à la 5-bromo-2′-désoxyuridine, ne se développe pas en milieu sélectif (HAT, réf. 6) et sécrète une protéine myélomateuse, Adj PC5, qui est une lgG2A (K), (réf. 1). La synthèse n’est pas équilibrée et des chaînes légères libres sont également sécrétées. La seconde lignée cellulaire, P3-X63Ag8, préparée à partir de P3 cclls 2, est résistante à 20 11g ml-1 de 8-azaguaninc et ne se développe pas en milieu HAT. La protéine sécrétée (MOPC 21) est une lgG I (K) qui a été entièrement séquencée. Un nombre égal de cellules de chaque lignée parentale a été fusionné à l’aide du virus inactivé de Sendai et des échantillons contenant 2 x 105 cellules ont été cultivés en milieu sélectif dans des boîtes séparées. Quatre boîtes sur dix ont montré une croissance en milieu sélectif et ont été considérées comme des lignées hybrides indépendantes, probablement dérivées d’événements de fusion uniques. Le caryotype des cellules hybrides après 5 mois de culture était juste inférieur à la somme des deux lignées parentales (tableau I). La figure I montre le schéma de focalisation isoélectrique (FIE) des produits sécrétés par les différentes lignées. Les cellules hybrides (échantillons c-h dans la figure 1) présentent un motif beaucoup plus complexe que les deux lignées parentales (a et b) ou qu’un mélange des lignées parentales (m). La caractéristique importante du nouveau motif est la présence de bandes supplémentaires (Fig. I, flèches). Ces nouvelles bandes ne semblent cependant pas résulter de différences dans la structure primaire, comme l’indique le schéma FIE des produits après réduction pour séparer les chaînes lourdes et légères (Fig. I B). Le profil FIE des chaînes des clones hybrides (Fig. I B, g) est équivalent à la somme des profils FIE (a et b) des chaînes des clones parentaux, sans aucune preuve de produits supplémentaires. Nous concluons que, comme cela a été montré précédemment avec les hybrides inter-espèces, de nouvelles molécules lg sont produites à la suite d’une association mixte entre les chaînes lourdes et légères des deux parents. Ce processus est intracellulaire, car une population de cellules mixtes ne donne pas naissance à de telles molécules hybrides (comparer m et g, Fig. lA). Les cellules individuelles doivent donc être capables d’exprimer les deux isotypes. Ce résultat montre que dans les cellules hybrides, l’expression d’un isotype et d’un idiotype n’exclut pas l’expression d’un autre : les deux isotypes de chaîne lourde (y1 et y2a) et les deux régions V11 et VL (idiotypes) sont exprimés. Il n’existe pas de marqueurs allotypiques pour la région C K permettant de prouver directement l’expression des deux régions C K parentales. Mais cela est indiqué par le lien phénotypique entre les régions V et C.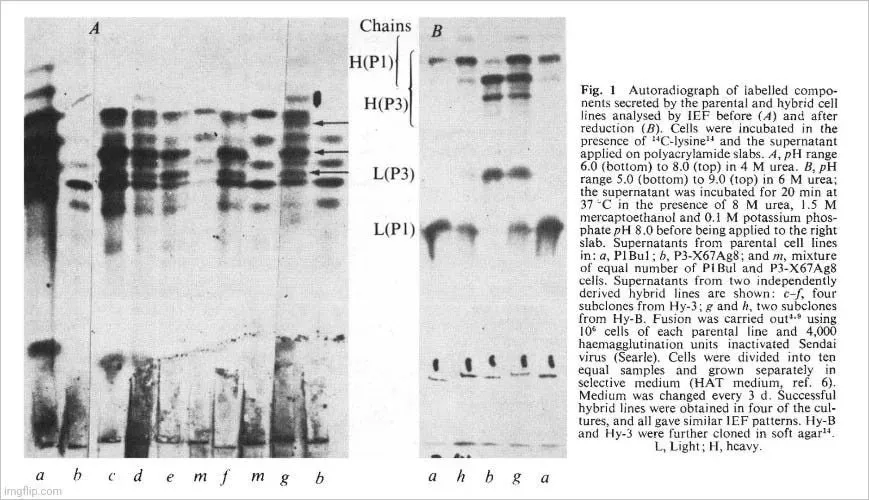
La figure I A montre que les clones issus de différentes expériences d’hybridation et de sous-clones d’une même lignée sont indiscernables. Ceci a également été observé dans d’autres expériences (données non montrées). Des variantes ont cependant été trouvées dans une étude de 100 sous-clones. La différence est souvent associée à des changements dans les rapports des différentes chaînes et parfois à la disparition totale de l’une ou l’autre des chaînes. De tels événements sont mieux visualisés par l’analyse FIE des chaînes séparées (par exemple, Fig. lh, dans laquelle la chaîne lourde de P3 n’est plus observée). Le fait important qu’aucune nouvelle chaîne ne soit détectée par FIE complète une étude précédente d’une lignée hybride rat-souris dans laquelle le brouillage des régions V et C des chaînes légères du rat et de la souris n’a pas été observé. Dans cette étude, les deux chaînes légères ont des régions C K identiques et les molécules VL-CL brouillées ne seraient donc pas détectées. D’autre part, les chaînes lourdes sont de sous-classes différentes et nous nous attendons à ce que les V H-C H brouillées soient détectables par FIE. Ils n’ont pas été observés dans les clones étudiés et, s’ils se produisent, c’est à une fréquence moindre. Nous concluons que dans les hybrides cellulaires syngéniques (ainsi que dans les hybrides cellulaires inter-espèces), l’intégration V-C n’est pas le résultat d’événements cytoplasmiques. L’intégration résultant d’une translocation ou d’un réarrangement de l’ADN pendant la transcription est également suggérée par la présence de molécules d’ARNm intégrées 11 et par l’existence de chaînes lourdes défectueuses dans lesquelles une délétion des sections V et C semble avoir lieu dans des cellules déjà engagées.
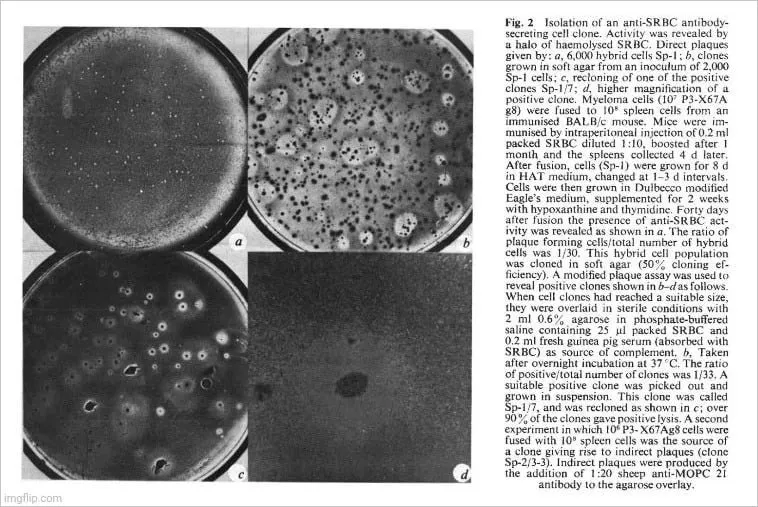
La lignée cellulaire P3-X63Ag8 décrite ci-dessus meurt lorsqu’elle est exposée au milieu HAT. Les cellules de la rate d’une souris immunisée meurent également dans le milieu de croissance. Lorsque les deux cellules sont fusionnées par le virus Sendai et que le mélange résultant est cultivé en milieu HAT, on peut observer que les clones survivants se développent et s’établissent après quelques semaines. Nous avons utilisé le SRBC comme immunogène, ce qui nous a permis, après avoir cultivé les lignées fusionnées, de déterminer la présence de cellules productrices d’anticorps spécifiques par une technique de dosage de plaque 13 (Fig. 2a). Les cellules hybrides ont été clonées dans une gélose molle 14 et les clones produisant des anticorps ont été facilement détectés par une superposition de SRBC et de complément (Fig. 2 b). Des clones individuels ont été isolés et il a été démontré qu’ils conservaient leur phénotype, car presque tous les clones de la lignée purifiée dérivée sont capables de lyser le SRBC (Fig. 2c). Les clones étaient visibles à l’œil nu (par exemple, figure 2 d). Des tests de plaque directs et indirects ont été utilisés pour détecter des clones spécifiques et des clones représentatifs des deux types ont été caractérisés et étudiés.
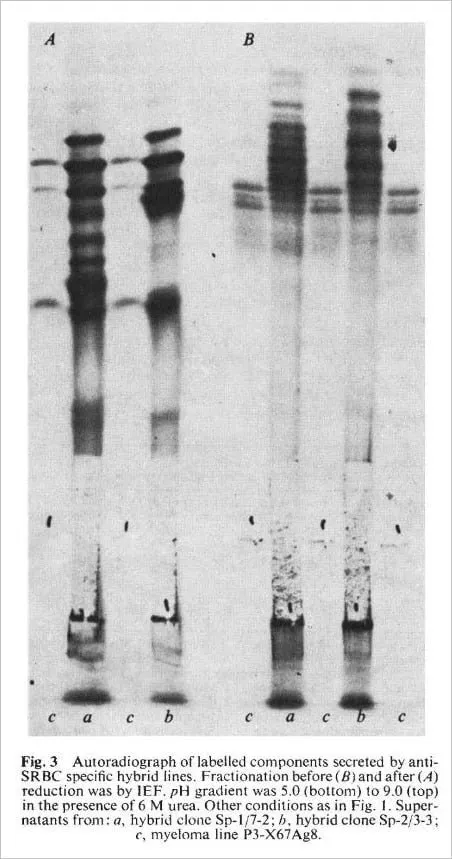
Les lignées dérivées (hybrides Sp) sont des lignées cellulaires hybrides pour les raisons suivantes. Elles poussent dans un milieu sélectif. Leur caryotype après 4 mois de culture (tableau 1) est un peu plus petit que la somme des deux lignées parentales, mais plus de deux fois le nombre de chromosomes des cellules BALB/c normales, ce qui indique que les lignées ne sont pas le résultat d’une fusion entre cellules de la rate. En outre, les lignées contiennent un chromosome métacentrique également présent dans la lignée parentale P3-X67Ag8. Enfin, les immunoglobulines sécrétées contiennent la protéine MOPC 21 en plus de nouveaux composants inconnus. Ces derniers représentent probablement les chaînes dérivées de l’anticorps spécifique anti-SRBC. La figure 3A montre le schéma FIE du matériel sécrété par deux clones hybrides Sp de ce type. Les bandes FIE dérivées de la lignée parentale P3 sont visibles dans le motif des cellules hybrides, bien qu’obscurcies par la présence d’un certain nombre de nouvelles bandes. Le motif est très complexe, mais la complexité des hybrides de ce type résulte probablement de la recombinaison aléatoire des chaînes (voir ci-dessus, Fig. 1). En effet, les modèles FIE du matériel réduit sécrété par les clones hybrides rate-P3 ont donné un modèle plus simple de chaînes légères. Les chaînes lourdes et légères de la lignée parentale P3 sont devenues proéminentes et de nouvelles bandes sont apparues.

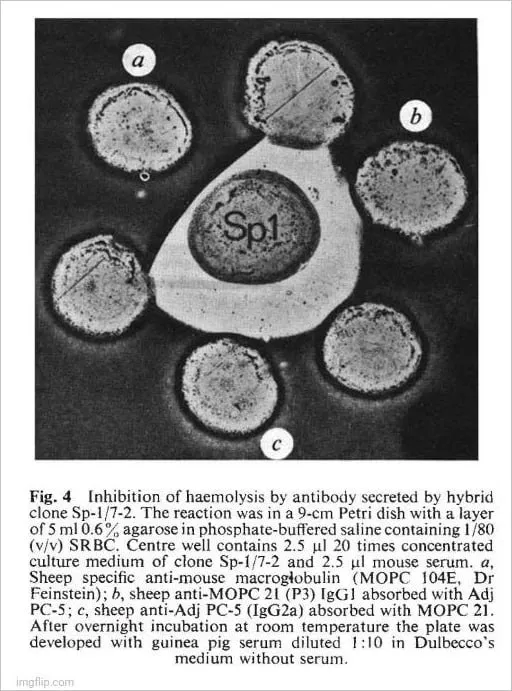
L’hybride Sp-1 a produit des plaques directes, ce qui suggère qu’il produit un anticorps anti-lgM. Ceci est confirmé par la figure 4 qui montre l’inhibition de la lyse des SRBC par un anticorps anti-lgM spécifique. Les techniques FIE ne révèlent généralement pas les molécules d’IgM 19S. Il est donc peu probable que l’IgM soit présente dans l’échantillon non réduit a (Fig. 3B), mais les chaînes u devraient contribuer au modèle obtenu après réduction (échantillon a, Fig. 3A).
Les résultats ci-dessus montrent que les techniques de fusion cellulaire sont un outil puissant pour produire des anticorps spécifiques dirigés contre un antigène prédéterminé. Ils montrent également qu’il est possible d’isoler des lignées hybrides produisant différents anticorps dirigés contre le même antigène et portant différentes fonctions effectrices (plaque directe et indirecte).
La population non clonée de cellules hybrides P3-spleen semble assez hétérogène. En utilisant des procédures de détection appropriées, il devrait être possible d’isoler des lignées de cellules de culture tissulaire produisant différentes classes d’anticorps. Pour faciliter nos études, nous avons utilisé une lignée parentale de myélome qui produisait elle-même un lg. Les variantes dans lesquelles l’une des chaînes parentales n’est plus exprimée semblent assez fréquentes dans le cas des hybrides Pl-P3 (Fig. lh). Par conséquent, la sélection de lignées dans lesquelles seules les chaînes d’anticorps spécifiques sont exprimées semble raisonnablement simple. Par ailleurs, des variantes non productrices de lignées de myélome pourraient être utilisées pour la fusion.
Nous avons utilisé le SRBC comme antigène. Trois expériences de fusion différentes ont permis de produire un grand nombre de cellules productrices d’anticorps. Trois semaines après la fusion initiale, 33/1 086 clones (3%) étaient positifs par le test de la plaque directe. L’efficacité du clonage dans cette expérience était de 50%. Dans une autre expérience, cependant, la proportion de clones positifs était considérablement plus faible (environ 0,2%). Dans une troisième expérience, la population hybride a été étudiée par analyse de dilution limitante. Sur 157 hybrides indépendants, autant d’aas15 avaient une activité anti-SRBC. La proportion de clones positifs par rapport aux clones négatifs est remarquablement élevée. Il est possible que les cellules de la rate qui ont été déclenchées pendant l’immunisation réussissent particulièrement bien à donner naissance à des hybrides viables. Il reste à voir si des résultats similaires peuvent être obtenus en utilisant d’autres antigènes.
Les cellules utilisées dans cette étude sont toutes d’origine BALB/c et les clones hybrides peuvent être injectés dans des souris BALB/c pour produire des tumeurs solides et du sérum ayant une activité anti-SRBC. Il est possible d’hybrider des cellules productrices d’anticorps d’origines différentes. Ces cellules peuvent être cultivées in vitro en masse pour produire des anticorps spécifiques. Ces cultures pourraient être précieuses pour des usages médicaux et industriels.
https://www.nature.com/articles/256495a0 https://doi.org/10.1038/256495a0

En résumé
• L’intérêt de Köhler et Milstein était de fabriquer des «anticorps» spécifiques prédéfinis à l’aide de lignées cellulaires permanentes de culture de tissus
• Ils ont indiqué que des lignées cellulaires permanentes de myélome (cancer) sont disponibles et que certaines ont été testées pour leur activité «anticorps», mais qu’elles ne constituent pas une bonne source d’«anticorps monoclonaux» spécifiques
• Ils ont donc décidé de fusionner des cellules de myélome et de rate de souris provenant d’une souris «immunisée» avec du sang de mouton.
• Ils affirment que les résultats de la fusion de cellules «produisant des anticorps» par un système hétérozygote impliquant des cellules de rat et de souris ont été confirmés par la fusion de cellules de souris de la même souche.
• Ils ont fusionné des cellules parentales de chaque souche avec le «virus» de Sendai
Petite remarque sur le «virus» Sendai utilisé pour fusionner ces cellules :
«Compte tenu de l’histoire, il n’est pas surprenant que de nombreux chercheurs aient mis en doute l’authenticité des premiers rapports d’infection humaine par le virus de Sendai. Le consensus actuel est que l’homme n’est pas un hôte naturel du virus de Sendai (Fukumi et al., 1954, 1959 ; Fukumi et Nishikawa, 1961 ; Chanock et al., 1963 ; Ishida et Homma, 1978) ; les hôtes naturels du virus de Sendai sont exclusivement des rongeurs de laboratoire».
https://www.sciencedirect.com/book/9780122625022/diseases
«En revanche, bien qu’il n’y ait aucune preuve que les rongeurs sauvages soient infectés par le virus de Sendai (SeV), et que son hôte naturel reste inconnu, le SeV provoque de graves épidémies dans les colonies de souris et de rats de laboratoire».
https://jvi.asm.org/content/73/4/3125
«En raison de la faible prévalence des signes cliniques, le meilleur moyen de poser un diagnostic est de détecter les anticorps dirigés contre le virus et de mettre en évidence des lésions typiques dans les voies respiratoires. Le test ELISA est le test de choix pour le diagnostic des infections par le virus de Sendai chez les rats».
https://www.sciencedirect.com/science/article/pii/B9780122639517500077
Le «virus» Sendai est inconnu dans la nature et les hôtes naturels de ce «virus» ne sont pas des rongeurs naturels, mais des rongeurs de LABORATOIRE…
Nous avons également un raisonnement circulaire où le «virus» est détecté par les «anticorps» en raison de l’absence de symptômes. Ainsi, une entité fictive est utilisée pour affirmer la présence de l’autre, et vice versa.• 4 cultures sur 10 ont montré une «croissance» et ont été considérées comme des lignées hybrides PROBABLEMENT dérivées d’événements de fusion uniques.
• Les cellules ont été cultivées pendant 5 mois.
• Ils ont utilisé la focalisation isoélectrique pour déterminer la similarité des motifs entre les lignées cellulaires parentales et hybrides.
Petite remarque sur la focalisation isoélectrique :
QU’EST-CE QUE LA FOCALISATION ISOÉLECTRIQUE ?
La focalisation isoélectrique (FIE) est un outil analytique puissant pour la séparation des protéines. Afin de garantir la haute performance de l’analyse, des étalons de point isoélectrique (pI) sont nécessaires. Outre les étalons classiques à base de protéines, des composés de faible poids moléculaire ont été mis au point et examinés avec succès dans le cadre de la FIE capillaire et de l’électrophorèse sur gel. L’électrophorèse sur gel, la technologie courante pour la FIE, minimise la convection et introduit un effet supplémentaire de séparation du gel pour séparer les protéines en fonction de leur taille. Elle présente toutefois plusieurs inconvénients, tels que la longueur du temps d’analyse, la résolution limitée et la difficulté de détection. Ces défis ont été largement surmontés par le développement de bandes IPG (gradients de pH immobilisés) utilisées pour la séparation haute résolution du pI».
«L’un des problèmes les plus critiques de la focalisation isoélectrique, que ce soit en électrophorèse capillaire ou en gel de dalle, est la normalisation des résultats. À cette fin, des étalons protéiques typiques ont été utilisés, ce qui peut présenter certains inconvénients :
Stabilité limitée des solutions ;
Pureté insuffisante pour une application en tant que norme ;
Incohérence d’un lot à l’autre».
https://www.sigmaaldrich.com/technical-documents/articles/biofiles/isoelectric-focusing.html
Comme on peut le constater, la focalisation isoélectrique est une méthode indirecte de séparation des protéines qui présente de nombreux inconvénients. Elle est incapable de dire ce que contient réellement le mélange ou si un seul type de protéine est présent.• Il n’y avait pas de marqueurs allyotopiques pour la région C K afin de fournir une preuve directe de l’expression des deux régions C K parentales.
• Ils affirment que les clones ne se distinguent pas des lignées parentales dans les données non montrées, mais déclarent ensuite que des variantes ont été trouvées dans une enquête portant sur 100 clones.
• L’intégration résultant d’une translocation ou d’un réarrangement de l’ADN au cours de la transcription a été suggérée par la présence de molécules d’ARNm intégrées et par l’existence de chaînes lourdes défectueuses dans lesquelles une délétion des sections V et C semblait avoir lieu dans les cellules déjà engagées.
• Les deux lignées cellulaires meurent seules dans leurs milieux respectifs, mais «survivent» lorsqu’elles sont fusionnées avec le «virus» Sendai et cultivées dans le milieu HAT.
• Le test des plaques a été utilisé pour déterminer indirectement les cellules «productrices d’anticorps» après leur mise en culture.
• Ils affirment que les cellules fusionnées sont hybrides parce qu’elles se sont développées dans leur milieu sélectif et que leur caryotype (le nombre et l’aspect visuel des chromosomes dans les noyaux cellulaires d’un organisme ou d’une espèce) est un peu plus petit que la somme des deux lignées parentales.
• Les lignes fusionnées contiendraient de nouveaux composants inconnus.
• Ils supposent que ces composants inconnus représentent les chaînes des anticorps anti-SRBC.
• Le modèle FIE a été qualifié de complexe, et les auteurs supposent que cela est probablement dû à une recombinaison aléatoire des chaînes.
• L’hybride a donné des plaques directes qui suggèrent qu’il produit un «anticorps» IgM
• Ils admettent que l’FIE ne révèle généralement pas les molécules d’IgM, et qu’il est donc peu probable qu’elles se trouvent dans l’échantillon non réduit.
• Ils affirment qu’il devrait être possible d’isoler des lignées cellulaires de culture tissulaire pour produire différentes classes d’«anticorps».
• Trois semaines après la fusion, seuls 3% (33/1 086) des clones étaient «positifs» après le test de la plaque.
• Seuls 15 sur 157 avaient une activité anti-SRBC.
• Les chercheurs ont déclaré qu’il restait à voir si des résultats similaires pouvaient être obtenus avec d’autres antigènes.
• Les clones hybrides utilisés dans l’étude peuvent être injectés à des souris pour produire des tumeurs.
• Ils affirment qu’il est désormais possible d’hybrider des cellules «productrices d’anticorps» in vitro (en laboratoire, en dehors d’organismes vivants) dans des cultures cellulaires massives

Cesar Milstein a parlé de la technologie des hybridomes et des raisons pour lesquelles il s’est impliqué dans l’immunologie lorsqu’il a reçu le prix Nobel en 1984. Dans son article intitulé «De la structure des anticorps à la diversification de la réponse immunitaire», il a déclaré que ce qui l’avait attiré dans l’immunologie «c’est que tout semblait tourner autour d’une expérience très simple : prendre deux molécules d’anticorps différentes et comparer leurs séquences primaires», notant que «le secret de la diversité des anticorps émergerait de cette expérience». Milstein a souligné qu’à l’époque, il avait la chance d’être «suffisamment ignorant du sujet pour ne pas réaliser à quel point j’étais naïf». De toute évidence, comme il est impossible de purifier et d’isoler un seul «anticorps» parmi les milliards qui seraient produits par l’organisme, son «expérience simple» n’était pas si simple.
Pour surmonter ce problème, les méthodes (pseudoscientifiques) de culture des tissus ont été introduites dans son laboratoire, ce qui «a eu un impact majeur sur l’orientation de nos recherches». Cependant, lorsqu’il a travaillé avec des cellules de myélome, Milstein a déclaré que, parmi les cellules de myélome disponibles, «aucune ne s’est avérée appropriée entre nos mains». Quoi qu’il en soit, Milstein a raconté que «d’une manière amusante, notre manque de succès a conduit à notre percée ; parce que, comme nous ne pouvions pas obtenir une lignée cellulaire sur étagère faisant ce que nous voulions, nous avons été obligés de la construire». En d’autres termes, Milstein et Köhler n’ont pas pu obtenir de résultats en utilisant les expériences déjà suspectes de culture de tissus avec des cellules de myélome ordinaires. Ils ont donc dû s’atteler à la fabrication d’une méthode pour créer des hybrides en utilisant des cellules cancéreuses de souris avec le «virus» Sendai et les cellules de la rate de souris, comme indiqué dans leur article fondateur, afin d’obtenir les résultats qu’ils souhaitaient obtenir.
Néanmoins, après les «premiers succès», Milstein a admis qu’ils «ont rencontré des difficultés techniques et n’ont pas pu faire fonctionner nos expériences de fusion pendant un certain temps». Ce n’est que lorsque Giovanni Galfré, une recrue qui a ensuite rejoint l’équipe, «a découvert que l’une de nos solutions de base avait été contaminée par une substance toxique» qu’un «protocole fiable amélioré a été mis au point». Cet extrait met en lumière l’une des principales façons d’expliquer les échecs de reproduction des résultats en utilisant l’excuse de la contamination. Il s’agit toujours d’«améliorer» la technologie ou les protocoles à l’avenir, et une fois que ces résultats se révèlent peu fiables, il y aura de nouvelles «améliorations» pour surmonter les nouvelles contradictions, sans jamais remettre en question les fondements frauduleux sur lesquels les résultats initiaux ont été construits.
Milstein a ensuite souligné que, lorsqu’un animal rencontre un antigène, «différents anticorps sont sécrétés et mélangés dans le sérum». Comme les «molécules d’anticorps» individuelles sont extrêmement similaires, «une fois mélangées, elles ne peuvent pas être séparées les unes des autres». Milstein a admis qu’il était impossible d’étudier la diversité de la réponse «anticorps» à un immunogène donné jusqu’à l’avènement de sa technologie des hybridomes. Il n’était donc pas possible d’étudier véritablement les «anticorps», car «on sait depuis longtemps que même les déterminants antigéniques les plus simples sont reconnus par une variété inconnue de molécules d’anticorps». Selon Milstein, la création des «anticorps monoclonaux» artificiels a permis de répondre aux vieilles questions concernant la complexité de l’ensemble des «molécules d’anticorps» produites par l’animal en réponse à un antigène particulier et la manière dont les molécules individuelles diffèrent les unes des autres. En d’autres termes, des entités créées artificiellement étaient censées pouvoir nous renseigner sur des processus inobservables se produisant dans la nature. Ignorant à quel point cette notion est ridicule, Milstein a fièrement proclamé que son invention pouvait répondre à la question suivante : «Comment, dans la vie réelle de l’animal, tous ces événements génétiques capables de produire une diversité d’anticorps opèrent-ils réellement en réponse à un stimulus antigénique ?» Il a déclaré que «l’immunochimie de l’avenir reviendra à une approche pédagogique où l’antigène nous dira quelle structure d’anticorps nous devons construire». Se rendant peut-être compte de l’ironie involontaire, Milstein a déclaré : «Bien qu’il ne s’agisse pas de science-fiction, nous devons surmonter les problèmes théoriques liés à la traduction d’une réalité unidimensionnelle en une prédiction tridimensionnelle valable». Milstein a admis que le «succès» de la technologie des hybridomes était «dans une large mesure le résultat des propriétés inattendues et imprévisibles de la méthode». Il s’agissait d’une recherche qui n’était pas «considérée comme commercialement intéressante ou d’une pertinence médicale immédiate» et qui «résultait de spéculations ésotériques, pour le plaisir de la curiosité, uniquement motivées par le désir de comprendre la nature».
Cependant, contrairement à la manière dont Milstein a voulu présenter son travail, il est clair que rien de proche de la réalité ne s’est produit dans leurs expériences de culture cellulaire, qui étaient un mélange monstrueux de cellules cancéreuses et de cellules de rate, d’antibiotiques, de sérum de vache et de divers additifs chimiques synthétiques qui ne se mélangeraient jamais à moins d’être rassemblés dans un laboratoire. Ces expériences n’ont permis de tirer aucune information susceptible d’aider à comprendre ce qui se passe réellement dans la nature. Les seules «théories» dérivées étaient des théories pseudoscientifiques entièrement issues de la science-fiction. Comme pour la virologie, l’horrible technique de la culture cellulaire a refait surface pour servir de preuve de concept, cette fois dans le cas des «anticorps monoclonaux». Faut-il s’étonner que ces cultures grotesques et non naturelles provoquent de telles maladies chez les humains auxquels elles sont injectées dans le cadre d’une thérapie par «anticorps monoclonaux» ? Les méthodes Frankenstein utilisées dans ces études n’ont rien de naturel. Les résultats des méthodes utilisées par Köhler et Milstein ne sont absolument pas une preuve de l’existence des substances hypothétiques invisibles. Tout ce que l’on peut tirer de ces expériences, c’est que la création d’un breuvage de sorcière en laboratoire a donné lieu à des affirmations non prouvées qui ont abouti à l’injection de ces concoctions directement chez l’homme, ce qui s’est avéré créer des maladies plutôt que la santé et l’«immunité». En d’autres termes, le contraire de la fonction proposée et de l’objectif visé par ces entités qui n’ont pas encore été prouvées.
 Eurasia Press & News
Eurasia Press & News